Химические свойства одноатомных фенолов. Получение, химические свойства и применение фенола. Примеры решения задач
Карболовая кислота — одно из названий фенола, указывающее на его особое поведение в химических процессах. Это вещество легче, чем бензол вступает в реакции нуклеофильного замещения. Присущие соединению кислотные свойства объясняются подвижностью атома водорода в гидроксильной группе, связанной с кольцом. Изучение строения молекулы и качественные реакции на фенол позволяют отнести вещество к ароматическим соединениям — производным бензола.
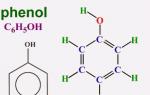
Фенол (гидроксибензол)
В 1834 году немецкий химик Рунге выделил карболовую кислоту из каменноугольной смолы, но не сумел расшифровать ее состав. Позже другие исследователи предложили формулу и отнесли новое соединение к ароматическим спиртам. Простейший представитель этой группы — фенол (гидроксибензол). В чистом виде это вещество представляет собой прозрачные кристаллы, обладающие характерным запахом. На воздухе цвет фенола может измениться, стать розовым или красным. Для ароматического спирта характерна плохая растворимость в холодной воде и хорошая — в органических растворителях. Плавится фенол при температуре 43°C. Является токсичным соединением, при попадании на кожу вызывает сильные ожоги. Ароматическая часть молекулы представлена радикалом фенилом (C6H5—). Непосредственно с одним из атомов углерода связан кислород гидроксильной группы (—OH). Присутствие каждой из частиц доказывает соответствующая качественная реакция на фенол. Формула, показывающая общее содержание атомов химических элементов в молекуле — C6H6O. Строение отражают включающие цикл Кекуле и функциональную группу — гидроксильную. Наглядное представление о молекуле ароматического спирта дают шаростержневые модели.
Особенности строения молекулы
Взаимовлияние бензольного ядра и ОН-группы определяет химические реакции фенола с металлами, галогенами, другими веществами. Наличие атома кислорода, связанного с ароматическим циклом, ведет к перераспределению электронной плотности в молекуле. Связь O—H становится более полярной, что приводит к увеличению подвижности водорода в гидроксильной группе. Протон может замещаться на атомы металла, что указывает на кислотность фенола. В свою очередь, ОН-группа повышает реакционные свойства бензольного кольца. Увеличивается делокализация электронов и способность к электрофильному замещению в ядре. При этом возрастает подвижность атомов водорода, связанных с углеродом в орто- и параположении (2, 4, 6). Такой эффект обусловлен наличием донора электронной плотности — гидроксильной группы. Благодаря ее влиянию фенол активнее чем бензол ведет себя в реакциях с некоторыми веществами, а новые заместители ориентируются в орто- и пара-положения.

Кислотные свойства
В гидроксильной группе ароматических спиртов атом кислорода приобретает положительный заряд, ослабляющий его связь с водородом. Высвобождение протона облегчается, поэтому фенол ведет себя как слабая кислота, но более сильная, чем спирты. Качественные реакции на фенол включают испытание лакмусовой бумажкой, которая в присутствии протонов изменяет цвет с синего на розовый. Наличие атомов галогенов или нитрогрупп, связанных с бензольным кольцом, приводит к росту активности водорода. Эффект наблюдается в молекулах нитропроизводных фенола. Понижают кислотность такие заместители, как аминогруппа и алкил (CH3—, C2H5— и другие). К соединениям, объединяющим в своем составе бензольное кольцо, гидроксильную группу и радикал метил, относится крезол. Его свойства слабее, чем карболовой кислоты.
Реакция фенола с натрием и щелочью

Подобно кислотам фенол взаимодействует с металлами. Например, вступает в реакцию с натрием: 2C6H5—OH + 2Na = 2C6H5—ONa + H2. Образуется и выделяется газообразный водород. Фенол взаимодействует с растворимыми основаниями. Происходит с образованием соли и воды: C6H5—OH + NaOH = C6H5—ONa + H2O. Способность отдавать водород в гидроксильной группе у фенола ниже, чем у большинства неорганических и карбоновых кислот. Вытесняет его из солей даже растворенный в воде диоксид углерода (угольная кислота). Уравнение реакции: C6H5—ONa + CO2 + H2O = C6H5—OH + NaHCO3.
Реакции бензольного кольца
Ароматические свойства обусловлены делокализацией электронов в бензольном ядре. Водород из состава кольца замещается на атомы галогенов, нитрогруппу. Подобный процесс в молекуле фенола проходит легче, чем у бензола. Один из примеров — бромирование. На бензол галоген действует в присутствие катализатора, получается бромбензол. Фенол реагирует с бромной водой при обычных условиях. В результате взаимодействия образуется белый осадок 2,4,6-трибромфенола, появление которого позволяет отличить испытуемое вещество от похожих на него ароматических соединений. Бромирование — качественная реакция на фенол. Уравнение: C6H5—OH + 3Br2 = C6H2Br3 + HBr. Второй продукт реакции — бромоводород. При взаимодействии фенола с разбавленной получаются нитропроизводные. Продукт реакции с концентрированной азотной кислотой — 2,4,6-тринитрофенол или пикриновая кислота имеет большое практическое значение.

Качественные реакции на фенол. Список
При взаимодействии веществ получаются определенные продукты, которые позволяют установить качественный состав исходных веществ. Ряд цветных реакций указывает на присутствие частиц, функциональных групп, что удобно использовать для химического анализа. Качественные реакции на фенол доказывают наличие в молекуле вещества ароматического кольца и OH-группы:
- В растворе фенола синяя лакмусовая бумажка краснеет.
- Цветные реакции на фенолы также проводят в слабой щелочной среде с солями диазония. Образуются желтые либо оранжевые азокрасители.
- Реагирует с бромной водой коричневого цвета, появляется белый осадок трибромфенола.
- В результате реакции с раствором хлорида железа получается феноксид трехвалентного железа — вещество синей, фиолетовой или зеленой окраски.

Получение фенолов
Производство фенола в промышленности идет в две либо три стадии. На первом этапе из пропилена и бензола в присутствии получают кумол (тривиальное название изопропилбензола). Уравнение реакции Фриделя-Крафтса: C6H5—OH + C3H6 = C9H12 (кумол). Бензол и пропилен в соотношении 3:1 пропускают над кислотным катализатором. Все чаще вместо традиционного катализатора — хлорида алюминия — используются экологически чистые цеолиты. На заключительной стадии проводят окисление кислородом в присутствии серной кислоты: C6H5—C3H7 + O2 = C6H5—OH + C3H6O. Фенолы могут быть получены из угля перегонкой, являются промежуточными соединениями в производстве других органических веществ.

Использование фенолов
Ароматические спирты находят широкое применение в производстве пластмасс, красителей, пестицидов и других веществ. Производство карболовой кислоты из бензола является первым шагом в создании ряда полимеров, в том числе поликарбонатов. Фенол вступает в реакцию с формальдегидом, получаются фенолформальдегидные смолы.

Циклогексанол служит сырьем для выпуска полиамидов. Фенолы применяются в качестве антисептиков и дезинфицирующих средств в дезодорантах, лосьонах. Используются для получения фенацетина, салициловой кислоты и других лекарственных препаратов. Фенолы находят применение в производстве смол, которые используются в электрических изделиях (выключатели, розетки). Они также используются в подготовке азокрасителей, например фениламина (анилина) . Пикриновая кислота, которая является нитропроизводным фенола, применяется для окрашивания тканей, изготовления взрывчатых веществ.
Малышенкова Е., Шикула Е. МОУ лицей № 102 г. Челябинска. /2010г Химия,10Б.
ТХС. Зависимость свойств … от строения.
Фено́лы (II )
Гидроксильная группа в феноле непосредственно связана с атомом углерода углеводородного радикала фенила, который оказывает на неё влияние. В отличие от радикалов предельных углеводородов, являющихся донорами электронов, бензольное кольцо, точнее, его радикал C6H5-, называемый фенилом, обладает особенностью оттягивать к себе электроны, в данном случае – от атомов кислорода гидроксильной группы –ОН. Это приводит к появлению на атоме водорода гидроксильной группы положительного заряда, что делает его более подвижным по сравнению с атомом водорода в группе –ОН спиртов, а само вещество фенол проявляет кислотные свойства.
В свою очередь, гидроксильная группа оказывает влияние на радикал. Под влиянием функциональной группы –ОН в бензольном кольце фенола электронная плотность распределяется неравномерно: частичный отрицательный заряд сосредоточен у атомов углерода, находящихся в 2,4,6-положениях. Это облегчает реакции замещения атомов водорода бензольного кольца именно в указанных положениях. В результате реакций замещения получают 2,4,6-производные фенола.


Физические свойства
Фенол – твёрдое бесцветное кристаллическое вещество, низкоплавкое, очень гигроскопичное, с характерным запахом. На воздухе фенол окисляется. Мало растворим в воде. Фенол легкоплавок, температура плавления 43°С. ФЕНОЛ ЯДОВИТ!!!
Химические свойства
Наличие в молекуле фенола как гидроксильной группы, так и бензольного кольца в углеводородном радикале фениле обуславливает его химические свойства. Наличие группы –ОН в молекуле делает некоторые его свойства схожими со свойствами спиртов.
Фенол реагирует с щелочными металлами
В отличии от одноатомных спиртов фенол реагирует со щелочами .
Фенол реагирует с бромной водой .
Фенол реагирует с азотной кислотой .
Фенол реагирует с водородом.
Фенол реагирует с серной кислотой .
Реакция фенола с натрием

Реакция фенола с гидроксидом натрия

Реакция фенола с бромной водой

Реакция фенола с азотной кислотой

Реакции фенола с серной кислотой


Реакция фенола с водородом

Качественные реакции на фенол /с бромной водой /

Реакция фенола с хлоридом железа (III 
Выводы
Фенолы – производные ароматических углеводородов (прежде всего бензола), в молекулах которых одна или несколько гидроксильных групп непосредственно связанны с атомами углерода бензольного кольца.
Химические свойства фенола обусловлены как функциональной группой -ОН, так и углеводородным ароматическим радикалом – фенилом (С6Н5-). На свойствах фенола сказывается взаимное влияние гидроксильной группы и бензольного ядра: в отличие от спиртов, он способен взаимодействовать как слабая кислота со щелочами, в отличие от бензола, в реакциях замещения атомов водорода бензольного кольца фенол образует 2,4,6-производные (трибромфенол, тринитрофенол и др.).
Соединения с одной или несколькими гидроксильными группами, присоединенными к бензольному кольцу; называются фенолами. Важнейшим из них является сам фенол:
Фенол был открыт в 1834 г., когда его выделили из каменноугольной смолы. Сначала его называли карболовой кислотой, и это название используется до сих пор для жидкого фенола, содержащего 5% воды. Свое нынешнее название фенол получил в 1841 г.
Все простейшие фенолы при нормальных условиях представляют собой твердые вещества с невысокой температурой плавления. Фенол - бесцветное кристаллическое вещество с температурой плавления 43°С. Он имеет характерный запах. Подобно спиртам, фенолы имеют более высокие температуры кипения, чем можно было бы ожидать по их относительной молекулярной массе. Это обусловлено образованием в фенолах межмолекулярной водородной связи. Выше уже отмечалось, что 2-нитрофенол имеет более низкую температуру кипения, чем 4-нитрофенол. Это объясняется существованием в первом из указанных соединений внутримолекулярной водородной связи, тогда как во втором соединении имеются межмолекулярные водородные связи, делающие его менее летучим (см. разд. 2.2).
Фенолы плохо растворяются в воде, но хорошо растворимы в органических растворителях, в частности в спиртах и эфирах. Фенол ограниченно смешивается с водой лишь при температурах ниже 66°С. Выше 66°С фенол смешивается с водой в любых пропорциях (см. рис. 6.22 и разд. 6.2).
Лабораторные способы получения
Для получения фенола в лабораторных условиях сплавляют при 300-350°С безводную натриевую соль бензолсульфоновой кислоты с твердым гидроксидом натрия, а затем добавляют к смеси разбавленную соляную кислоту:

Бензолсульфоновую кислоту получают сульфированием бензола (см. разд. 18.2). Нейтрализация этой кислоты гидроксидом натрия приводит к образованию ее натриевой соли.
Фенол получают также, подогревая выше 10°С водный раствор хлорида фенилдиазония:

Хлорид фенилдиазония получают диазотированием фениламина (см. разд. 19.4).
Химические свойства фенолов
Реакции гидроксильной группы. Кислотность. Фенол имеет константу кислотности равную 9,95. Таким образом, он обладает свойствами слабой кислоты, хотя и более сильной, чем Метанол, этанол и вода (см. табл. 19.4). Фенолятион, образующийся в результате отщепления иона стабилизируется благодаря делокализации
отрицательного заряда:

Он может рассматриваться как гибрид указанных резонансных форм (см. разд. 2.1 и 18.2).
Подобно спиртам, фенол реагирует с сильно электроположительными металлами, например с натрием, выделяя водород:

Однако в отличие от спиртов фенолы реагируют с гидроксидом натрия:

Фенол обладает не настолько большой кислотностью, как карбоновые кислоты. Карбоновые кислоты, например уксусная или бензойная, способны вытеснять диоксид углерода из гидрокарбоната натрия или карбоната натрия, а фенол не способен. Этой реакцией пользуются в аналитических целях, чтобы отличить карбоновые кислоты от фенолов.
Образование сложных эфиров. Хотя фенол не реагирует с карбоновыми кислотами с образованием сложных эфиров, он реагирует с хлорангидридами карбоновых кислот в щелочных растворах:

Реакция этого типа называется ацилированием.
Образование простых эфиров. Фенол реагирует с галогеноалканами в щелочной среде, образуя простые эфиры:

Эта реакция является примером синтеза Вильямсона (см. предыдущий раздел).
Реакция с пентахлоридом фосфора. В отличие от спиртов фенол не реагирует с галогеноводородами и тригалогенидами фосфора. Однако он медленно реагирует с пентахлоридом фосфора, образуя хлоробензол с низким выходом:

Реакция с хлоридом железа (III). При добавлении нейтрального раствора хлорида железа (III) к фенолу происходит образование комплекса, имеющего фиолетовую окраску. Эта реакция используется в качестве аналитической пробы на фенол. Такая реакция характерна для соединений, содержащих енолъную группу.

Реакция в бензольном кольце. Бензольное кольцо в молекуле фенола подвергается электрофильному замещению легче, чем сам бензол. Это объясняется тем, что несвязывающие электроны на атоме кислорода втягиваются в бензольное кольцо и тем самым активируют его. Гидроксильная группа фенола обладает 2,4-направляющим действием в отношении электрофильных заместителей (см. разд. 18.2).
Галогенирование. Галогенирование фенолов осуществляется в гораздо более мягких условиях, чем галогенирование бензола. Например, при добавлении бромной воды к водному раствору фенола происходит образование белого осадка 2,4,6-трибромо-фенола:

В разд. 18.2 было указано, что бромирование бензола требует присутствия катализатора.
Нитрование. Фенол можно нитровать с помощью разбавленной азотной кислоты. При этом образуется смесь 2-нитрофенола и 4-нитрофенола:

Сопоставим опять эти мягкие условия с условиями протекания соответствующей реакции бензола. Нитрование бензола требуется проводить в смеси концентрированных азотной кислоты и серной кислоты (см. разд. 18.2).
2-Нитрофенол и 4-нитрофенол являются более сильными кислотами, чем фенол. Оба они характеризуются значениями приблизительно равными 7,2. Повышенная кислотность нитрофенолов объясняется тем, что нитрогруппа оттягивает на себя электроны. В результате бензольное кольцо сильнее оттягивает электроны от атома кислорода гидроксильной группы.
Сульфирование. Реакция фенола с концентрированной серной кислотой приводит к образованию смеси гидроксибензолсульфоновых кислот:

Гидроксибензолсульфоновая кислота (выход 85%)
Оба продукта этой реакции реагируют с концентрированной азотной кислотой, образуя 2,4,6-тринитрофенол - желтое кристаллическое вещество, известное под тривиальным названием «пикриновая кислота»:

Вследствие общего электроноакцепторного действия трех нитрогрупп пикриновая кислота оказывается сравнительно сильной кислотой. Она характеризуется константой кислотности близкой к 1, а при взаимодействии с раствором карбоната натрия вытесняет из него диоксид углерода.
Реакции сочетания. Щелочный раствор фенола реагирует с раствором хлорида фенилдиазония, в результате чего образуется оранжевый осадок 4-гидроксифенилазо-бензола:

Этот продукт представляет собой азокраситель. Реакция подобного типа называется реакцией сочетания (в данном случае азосочетания).
Описание презентации по отдельным слайдам:
1 слайд
Описание слайда:
2
слайд

Описание слайда:
Цель: Дать характеристику физических и химических свойств фенола Показать отрицательную и положительную роль в природе и жизни человека фенола и его производных
3
слайд

Описание слайда:
Фенол (оксибензол, устар. карболовая кислота) C6H5OH - простейший представитель класса фенолов. Кристаллическое, бесцветное вещество с характерным запахом. На воздухе легко окисляется, приобретая вначале розовую, затем бурую окраску. Игольчатые кристаллы фенола
4
слайд

Описание слайда:
Классификация фенолов Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле:
5
слайд

Описание слайда:
Получение Кумольный способ получения фенола (СССР, Сергеев П.Г., Удрис Р.Ю., Кружалов Б.Д., 1949 г.). Преимущества метода: безотходная технология (выход полезных продуктов > 99%) и экономичность. Сплавлением солей ароматических сульфокислот с твёрдыми щелочами: C6H5-SO3Na + NaOH t → Na2SO3 + С6H5 – OH Из каменноугольной смолы: C6H5ONa + H2SO4(разб) → С6H5 – OH + NaHSO4 Из галогенбензолов: С6H5-Cl + NaOH t,p → С6H5 – OH + NaCl
6
слайд

Описание слайда:
Физические свойства Растворим в воде (6 г на 100 г воды), в растворах щелочей, в спирте, в бензоле, в ацетоне. Фенол крайне ядовит и опасен для человеческого организма
7
слайд

Описание слайда:
Электронное строение Гидроксильная группа -OH является заместителем I рода, то есть она способствует повышению электронной плотности в бензольном кольце (особенно в орто- и пара-положениях). Это обусловлено тем, что одна из неподелённых пар электронов атома кислорода OH-группы вступает в сопряжение с π-системой бензольного кольца. Смещение неподелённой пары электронов атома кислорода в сторону бензольного кольца приводит к увеличению полярности связи O-H.
8
слайд

Описание слайда:
Химические свойства Взаимодействие с металлическим натрием: 2C6H5OH + 2Na 2C6H5ONa + H2 Обладает слабыми кислотными свойствами, при действии щелочей образует соли - феноляты (например, фенолят натрия - C6H5ONa): C6H5OH + NaOH C6H5ONa + H2O Взаимодействие с бромной водой (качественная реакция на фенол): C6H5OH + 3Br2 C6H2Br3OH + 3HBr (образуется твёрдое вещество белого цвета 2,4,6-трибромфенол) Взаимодействие с концентрированной азотной кислотой: C6H5OH + 3HNO3 C6H2(NO2)3OH + 3H2O (образуется 2,4,6-тринитрофенол) Взаимодействие с хлоридом железа(III) (качественная реакция на фенол): 6C6H5OH + FeCl3 Cl3
9
слайд

Описание слайда:
Биологическая роль Эфирные масла (обладают сильными бактерицидными и противовирусными свойствами, стимулируют иммунную систему, повышают артериальное давление: - анетол в укропе, фенхеле, анисе - карвакрол и тимол в чабреце - эвгенол в гвоздике, базилике Флавоноиды (способствуют удалению радиоактивных элементов из организма) Лекарственные препараты (пурген, парацетамол) Антисептики (3-5 % раствор –карболовая кислота) Фенол - один из промышленных загрязнителей. Фенол довольно токсичен для животных и человека. Фенол губителен для многих микроорганизмов, поэтому промышленные сточные воды с высоким содержанием фенола плохо поддаются биологической очистке.
10
слайд

Описание слайда:
Токсические свойства Относится к высокоопасным веществам (Класс опасности II). При вдыхании вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу, вызывая химические ожоги. Попадая на кожу, фенол очень быстро всасывается даже через неповреждённые участки и уже через несколько минут начинает воздействовать на ткани головного мозга.
11
слайд

Описание слайда:
Токсические свойства Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюшностью, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами
12
слайд

Описание слайда:
Воздействие на организм При попадании фенольного раствора на кожный покров сразу же появляются сильные ожоги химического характера, переходящие в язвы. Если четверть всей поверхности тела обожжена воздействием фенола, то вероятность смерти близка к 100%. Попадание вещества в организм через желудочно-кишечный тракт способствует затруднению движения, может спровоцировать кровотечение, язву. Смертельная доза для человека при попадании внутрь 1-10 г, для детей 0,05-0,5 г. Несмотря на быстрый период выведения из организма (всего сутки), фенол способен нанести непоправимый урон, а лечение может занять несколько лет. Наиболее серьезные последствия – развитие онкологических заболеваний, бесплодие, проблемы с сердцем.
Названия фенолов составляют с учетом того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название «фенол». Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с гидроксильной группой (если она является старшей функцией), и продолжают в такой последовательности, чтобы имеющиеся заместители подучили наименьшие номера.
Монозамещенные производные фенола, например метилфенол (крезол), могут существовать в виде трех структурных изомеров - орто-, мета- и паракрезолов.
Физические свойства.
Фенолы в большинстве своем - кристаллические вещества (-крезол - жидкость) при комнатной температуре. Они обладают характерным запахом, довольно плохо растворимы в воде, но хорошо растворяются в водных растворах щелочей (см. ниже). Фенолы образуют прочные водородные связи и имеют довольно высокие температуры кипения.
Способы получения.
1. Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
2. Получение из ароматических сульфокислот (см. реакцию 3 в разделе «Химические свойства бензола», § 21). Реакция проводится при сплавлении сульфокислот с щелочами. Первоначально образующиеся феноксиды обрабатывают сильными кислотами для получения свободных фенолов. Метод обычно применяют для получения многоатомных фенолов:

Химические свойства.
В фенолах р-орбиталь атома кислорода образует с ароматическим кольцом единую -систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О-Н увеличивается, и водород ОН-группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов).
Кроме того, в результате такого взаимного влияния в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и кара-положениях в реакциях электрофильного замещения (галогенирования, нитрования, поликонденсации и т.д.):

1. Кислотные свойства фенола проявляются в реакциях со щелочами (сохранилось старинное название «карболовая кислота»):
Фенол, однако, является очень слабой кислотой. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол - такая реакция доказывает, что фенол - более слабая кислота, чем угольная и сернистая:
Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода.
2. Образование сложных эфиров. В отличие от спиртов, фенолы не образуют сложных эфиров при действии на них карбоновых кислот; для этого используются хлоран-гидриды кислот:
3. Галогенирование. При действии на фенол бромной воды (сравните с условиями бромирования бензола - § 21) образуется осадок 2,4,6-трибромфенола:

Это - качественная реакция для обнаружения фенола.
4. Нитрование. Под действием 20%-ной азотной кислоты фенол легко превращается в смесь орто- и пара-нитрофенолов. Если нитровать фенол концентрированной азотной кислотой, то образуется 2,4,6-тринитрофенол - сильная кислота (пикриновая).
5. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха.
Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона образуется хинон: